6일 삼일제약에 따르면 지난달 미국 샌디에고 소재 바이오텍 바이오스플라이스 테라퓨틱스가 개발 중인 로어시비빈트의 임상 3상 장기 연장시험 결과가 최근 발표됐다.
|
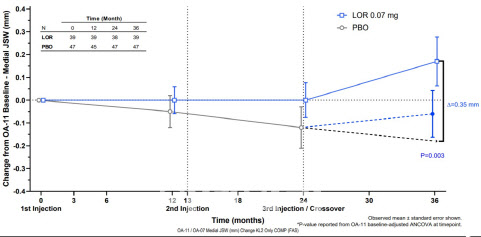
미국에서 로어시비빈트를 연 1회씩 3년간 투약했을 때 시험군의 무릎 관절 내측 공간 폭을 의미하는 ‘mJSW’가 위약군 대비 0.26㎜ 더 넓은 것으로 나타나 임상 및 통계적으로 유의한 결과를 확인했다. 통상 mJSW 너비에 따라 골관절염 진행 정도를 판단하는데, mJSW가 증가할수록 골관절염이 개선된 것으로 본다.
로어시비빈트는 삼일제약이 지난 2021년 3월 1000만 달러(약 113억1700만원)에 미국 바이오스플라이스 테라퓨틱스로부터 국내 판권을 사온 골관절염 치료제 후보물질이다.
이 소식에 삼일제약 주가는 지난 4일 장중 한 때 전일 대비 14.8% 오른 7180원에 거래되기도 했다. 거래량은 직전 영업일인 1일 대비 54배 늘었다.
회사 관계자는 “로어시비빈트는 2025년 미국 식품의약국(FDA) 허가, 2026년 한국 식품의약국안전처 허가를 목표로 하고 있다”며 “노령화로 골관절염 치료제 시장이 빠르게 성장하고 있는 가운데, 기존 치료제에 부족함을 느끼는 환자들에게 또 다른 치료옵션을 제공할 수 있을 것”이라고 말했다.
|
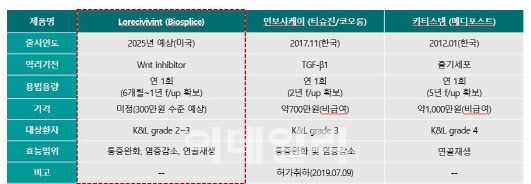
보건의료빅데이터 개방시스템에 따르면 지난해 국내 퇴행성 관절염 환자수는 418만명이며, 국내 전체 퇴행성 관절염 치료제 시장규모도 4750억원에 달한다. 이중 국내 골관절염 치료제 시장은 대부분 통증완화 효과를 가진 히알루론산(HA) 주사제와 폴리뉴클레오타이드 나트륨(PN) 주사제가 차지하고 있다. 로어시비빈트는 통증완화 관절강주사제가 아닌 연골재생 분야를 타깃한다. 이 분야에서는 통증완화 및 연골재생 효과를 입증한 줄기세포치료제인 메디포스트의 ‘카티스템’, 인공관절 치환술 등이 있다. 카티스템의 연 매출은 약 200억원 수준으로, 매년 조금씩 성장하는 추세다.
회사측은 로어시비빈트가 인공관절 치환술이나 줄기세포치료제 수요 일부를 흡수할 수 있을 것으로 본다. 약가도 줄기세포치료제인 카티스템보다 저렴하게 책정될 것으로 기대된다. 카티스템의 비급여 약가는 수술전후 입원비까지 고려했을 때 약 1000만원 수준인데, 회사측은 로어시비빈트의 약가를 이보다 낮은 300만원 수준으로 예상하고 있다.
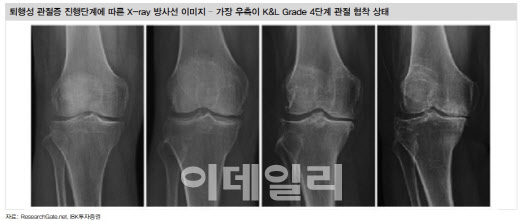
특히 전체 골관절염 환자의 65%를 차지하는 초기 골관절염 환자(K&L 2~3등급)에게서 약효가 크게 나타났다는 점도 로어시비빈트의 차별점이다. 보통 골관절염 환자는 무릎뼈 사이 연골이 정상인 경우 ‘0등급’, 연골이 닳아 무릎뼈 사이 간격이 좁아졌지만 약물치료가 가능한 ‘1등급’, 주사치료나 수술적 치료가 가능한 ‘2~3등급’, 인공관절 수술을 요하는 ‘4등급’으로 구분된다. 카티스템은 관절 간격이 판단 기준이 되는 K&L과 달리 연골 손상을 기준으로 환자 상태를 판단하는 ICRS 4등급 환자를 대상으로 식약처의 허가를 받았는데, 주로 중등증 이상의 골관절염 환자들이 택하는 수단이다. 이 때문에 로이시비빈트는 경증 골관절염 환자를 포괄하는 더 큰 시장을 공략할 수 있다는 게 회사측 설명이다.
|
삼일제약은 향후 로어시비빈트가 FDA로부터 DMOAD로 인정받을 가능성도 기대하고 있다. 근본치료제를 의미하는 DMOAD로 지정될 경우 국내 시장에서 압도적으로 세를 늘릴 수 있을 것으로 전망된다. 애초 임상 3상 역시 DMOAD 지정을 목표로 설계됐다는 설명이다. 다만 아직 세계적으로 DMOAD로 인정받은 치료제가 없을 정도로 DMOAD 인정이 쉬운 일은 아니어서 향후 결과에 관심이 쏠린다. DMOAD가 되려면 관절의 통증완화 및 기능개선 효과뿐만 아니라 구조적 질병진행 억제 및 회복효과까지 입증해야 하기 때문이다.
현재 삼일제약에서 가장 큰 매출을 차지하는 의약품은 위장관운동조절제 ‘포리부틴’이다. 로어시비빈트가 카티스템보다 저렴한 약가를 앞세워 시장에 침투한다면 최소한 카티스템과 비슷한 수준의 매출은 확보할 수 있을 것으로 보인다. 회사에서도 2026년 로어시비빈트가 국내 시장에 본격 출시되면 연간 133억원의 매출을 올리는 포리부틴을 금세 추월해 주력 캐시카우 제품으로 떠오를 수 있을 것으로 전망하고 있다.
삼일제약 관계자는 “로어시비빈트는 투약시 사용되는 바늘 크기가 작아 투약 시점은 물론 투약 이후에도 통증 이슈가 줄어들 것으로 기대된다”며 “연골에 천공을 뚫는 과정이 불필요해 경쟁약물 대비 빠른 회복이 가능하다. 만약 DMOAD로 지정된다면 ‘세계 최초’ 타이틀까지 확보해 경쟁약물 대비 우월성을 확립할 수 있을 것”이라고 설명했다.

![노래방 도우미에 빠진 공무원 남편 어떡하죠[양친소]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042700021t.jpg)



