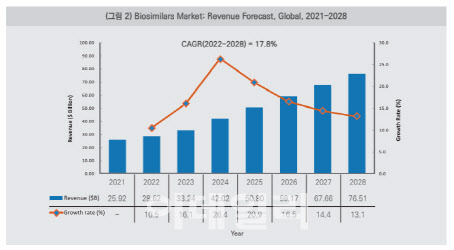
한국바이오협회는 ‘글로벌 바이오시밀러 시장 현황 및 매출 전망’이라는 제목의 보고서를 30일 발표했다.
지난해 기준 미국은 40개, 유럽연합(EU)은 64개의 바이오시밀러가 허가당국으로부터 승인받았다. 아시아에서는 한국과 일본과 인도가 시장을 선도할 것으로 예상된다. 특히 인도의 경우 승인받은 바이오시밀러가 127개에 달한다.
중국도 바이오시밀러 개발에 힘쓰는 추세다. 이는 독일과 미국을 능가하는 수치다. 중국은 16개 분야를 대상으로 총 142개의 바이오시밀러 mAbs를 보유하여 바이오시밀러 R&D 분야에서 주요 국가로 부상했으며, 60개 이상의 제약회사가 바이오시밀러 의약품 개발에 힘쓰고 있다.
|
2028년 내 특허 독점권 만료가 예상되는 의약품으로는 티사블, 빅토자, 솔리리스, 졸레어, 아라네스프, 심지아, 프롤리아 등을 꼽았다.
치료 분야별 매출 비중은 면역학 분야가 올해 14.9%에서 2028년 37.8%로 커질 것으로 분석했다. 최근 아달리무맙(휴미라의 성분명) 바이오시밀러 출시와 더불어 토실리주맙(악템라의 성분명), 우스테키누맙(스텔라라의 성분명) 등의 출시가 예정돼있기 때문이다. 면역학 다음으로는 종양학이 같은 기간 10.6%에서 20.6%, 안과 부문이 4.7%에서 12.8%로 커지며 각각 2위, 3위를 차지할 전망이다.
하지만 바이오시밀러 시장에서 살아남기 위해서는 승인 이후 ‘판매’ 단계가 중요한만큼 신흥국이 단기간에 격차를 따라잡기란 힘들 것이란 분석도 나온다.
바이오업계 관계자는 “결국 미국 시장에서 누가 영업을 잘하는 지에 따라서 승부가 갈릴 것”이라며 “바이오시밀러는 1라운드가 승인이라면, 각 회사의 마케팅 역량에서 2라운드가 시작된다. 보험사와의 네트워크는 새로운 경쟁사들이 빨리 얻기 어려운 무형자산”이라고 말했다.







![쇼핑성지 옛말, 상가 통으로 '임대' 딱지…"팔 수 있다면 20억도 깎죠"[르포]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031100390t.jpg)
![서초구 아파트 19층서 떨어진 여성 시신에 남은 '찔린 상처' [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031100013t.jpg)