|
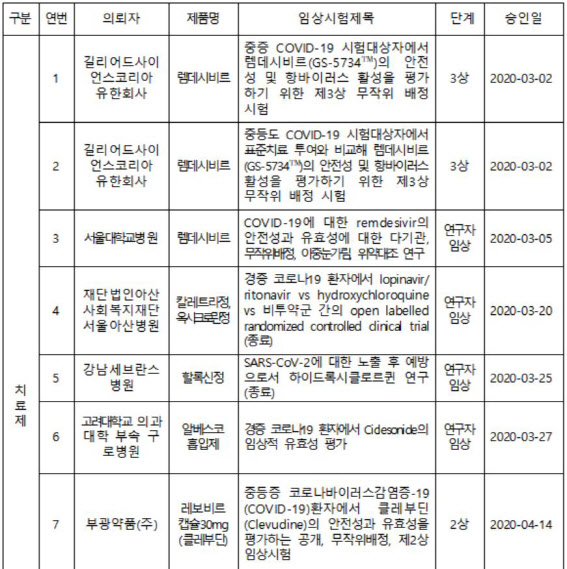
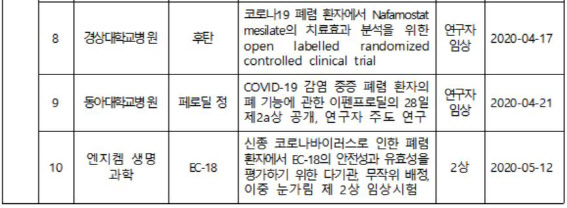
26일 식품의약품안전처에 따르면 코로나19 치료제 임상 3상은 2건, 2상 4건, 연구자 임상 시험 7건 등 13건에 달한다. 이 중 우리나라에서 개발한 치료제로는 B형 간염 치료제로 허가된 부광약품(003000)의 클레부딘이 2상 진행 중이며 신풍제약(019170)의 말라리아 치료제인 피라맥스가 2상, 엔지켐생명과학(183490) EC-18 2상, 종근당(185750) 항응고제 나파모스타트가 2상 단계에 있다.
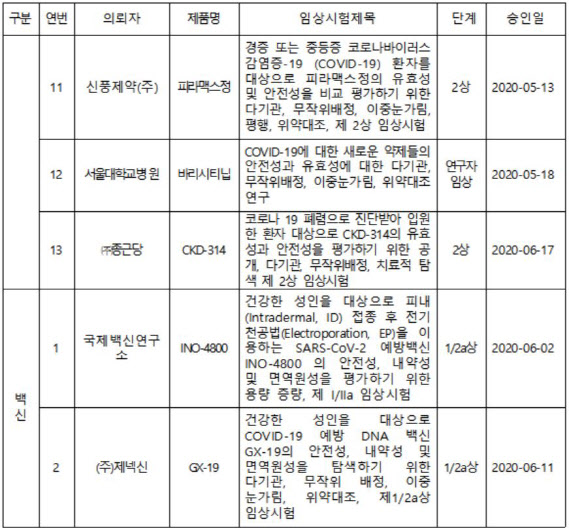
백신에 대한 임상 시험은 2건 모두 초기 단계(1상~2상)에 있는 것으로 전해졌다. 우리나라가 개발 중인 백신으로는 제넥신(095700)의 DNA 백신 ‘GX-19’가 1·2상을 진행하고 있다.
국내 임상 시험을 준비 중이거나 해외에서 임상 중인 코로나19 치료제를 보면 항체 치료제로 미국 대형 제약회사 일라이 릴리사(社)가 임상 시험을 진행하고 있다. 류머티즘 관절염 치료제로 사용되고 있는 로슈의 ‘악템라’ 제품도 미국·중국 등에서 임상을 진행하고 있다.
국내에선 셀트리온(068270)이 항체 치료제를 개발하고 있으며 임상 시험 준비 단계에 있다. 혈장 치료제론 GC녹십자(006280)가 완치된 환자의 혈장을 이용한 치료제를 개발하고 있으며, 현재 임상 2상을 준비하고 있다.
다만 코로나19 예방을 위한 백신 중 아직까지 세계적으로 상용화된 제품은 없다고 식약처는 설명했다.
해외에서는 영국 옥스퍼드대가 개발 중인 백신이 임상 2·3상 단계에 있고, 중국과 미국 회사가 개발 중인 백신이 2상, 이 외에 12개 백신이 1·2상 또는 1상 단계에 있는 것으로 알려졌다.
|
|
|
최근 영국에서의 연구 결과 발표로 기대를 모았던 스테로이드 제제 ‘덱사메타손’에 대해서는 중증 환자에 한정해 투여하는 게 적절하다는 의견을 냈다. 식약처는 “면역억제 작용을 통해 치료 효과를 나타내는 것으로 급성호흡기증후군과 같은 ‘중증’ 환자에 한정해 의사가 환자 상태를 관찰하면서 투여하는 것이 적절할 것으로 보인다”고 밝혔다.
현재 덱사메타손의 국내 수급은 원활한 상태다. 정제 및 주사제 14개 품목이 생산되고 있으며 정제는 연간 약 4300만정, 주사제는 연간 약 6000만 앰플이 생산되고 있다.
말라리아 치료제 클로로퀸 계열 의약품 ‘히드록시클로로퀸’은 국내에서 진행되던 총 5건의 임상 시험이 전부 중단됐다. 식약처는 “국내에서는 총 5건의 히드록시클로로퀸 임상 시험이 승인됐으나, 국내외 임상 시험에서 치료적 유익성이 인정되지 않는 등 5건 모두 조기 종료 등 지금은 임상 시험에 사용되고 있지 않다”고 공개했다.
이달 들어 세계보건기구(WHO)와 미국 국립보건원(NIH)은 임상 시험 자료를 분석한 결과, 환자에게 치료적 유익성이 인정되지 않는 것으로 판단돼 히드록시클로로퀸에 대한 임상 시험 중단을 각각 발표했다.
앞으로도 식약처는 코로나19 치료제·백신의 사용 및 개발 동향을 지속적으로 모니터링 해 나갈 계획이다. 식약처 관계자는 “국내 품목허가 및 공급에 필요한 사항을 지원해 우리 국민의 치료 기회를 보장할 수 있도록 최선을 다할 방침”이라고 강조했다.


![저수지에 떠오른 검은색 가방…네살 배기 시신이었다 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120300003t.jpg)
![영하권 아침 기온에 강풍까지…일부 지역은 눈·비[오늘날씨]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/12/PS24120300017t.jpg)

