이들의 유전자 치료제가 개발에 성공한다면 ‘루센티스’나 ‘아일리아’ 등 ‘항VEGF(혈관내피세포성장인자)’ 제제들은 상당한 영향을 받을 것으로 예상된다. 특허만료를 앞둔 아일리아 바이오시밀러를 개발 중인 셀트리온(068270)이나 알테오젠(196170), 삼성바이오에피스 등도 이를 예의주시하고 있다.
|
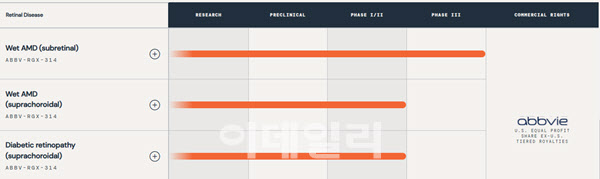
양사에 따르면 ABBV-RGX-314는 VEGF 항체를 발현시키는 유전자를 바이럴 벡터인 ‘아데노연관바이러스(AAV)8’에 탑재시킨 유전자 치료 신약 후보물질이다. 지난 2021년 리젠엑스바이오로부터 총 17억5000만 달러 규모로 ABBV-RGX-314를 기술이전받은 애브비가 현재 해당 물질의 글로벌 임상을 주도하고 있다.
노화로 인한 3대 안과질환인 습성황반변성은 심각한 시력저하 및 실명 등을 일으키는 것으로 알려졌다. 애브비에 따르면 습성 황반변성 환자 대상 맥락막 투약 방식으로 진행중인 ABBV-RGX-314의 임상 2상은 ‘저·중·고’등 세 가지 용량군으로 나눈 다음, 총106명의 습성 황반변성환자 환자에게 투약됐다. 대표적인 항VEGF제제인 ‘루센티스’를 월1회 투약하는 그룹이 대조군으로 설정됐다.
그 결과 1차 평가 지표인 ABBV-RGX-314 투여 후 40주차 시점에서 ‘최고교정시력’(BCVA)이 월1회 루센티스 투여군 대비 우수하게 나타났다. 해당 시점까지 50명 이상을 배정한 고용량 투여군의 경우 항VEGF제제의 연간 투약 필요성이 80% 가량 감소했다. 특히 해당 투약군의 50%는 항VEGF 제제 투약할 필요가 없는 상황이 확인됐다.
스티브 파콜라 리젠액스바이오 최고의학책임자(CMO)는 “눈에 빈번하게 주사하게 되는 항 VEGF제제는 치료 부담이 크다”며 “단 한번의 주사로 긴 치료 효과를 입증하면 항VEGF제제를 대체할 주요 치료 옵션이 될 수 있을 것”이라고 설명했다.
애브비와 리제넥스바이오는 ABBV-RGX-314를 통해 습성 황반변성 대상 ‘망막하’ 투하 방식의 임상 3상과 앞서 언급한 맥락막 투약 방식의 임상 1/2상을 수행하는 중이다. 이외에도 양사는 당뇨병성 망막질환 대상 ABBV-RGX-314의 임상 1/2상을 병행하고 있다.
|
이중 루센티스의 주요 물질특허가 이미 만료돼 매출이 쪼개지기 시작했다. 삼성바이오에피스의 ‘바이우비즈’나 미국 코히러스바이오사이언스의 ‘시멜리’(유럽제품명 라니비시오) 등 바이오시밀러가 이미 미국이나 유럽 연합에서 2022년 하반기부터 출시된 상황이다. 또 아일리아의 물질특허는 미국에서 올해 5월, 유럽에선 내년 11월에 만료된다. 아일리아의 제형이나 제법 관련 특허가 지역에 따라 2027~2030년까지 유지되지만, 바이오시밀러 개발사들은 다른 특허를 회피하거나 합의하는 방식으로 되도록 빠르게 시장 진입을 준비하고 있다.
국내에서는 삼성바이오에피스와 셀트리온, 삼천당제약 등이 각각 저용량 버전의 아일리아 바이오시밀러의 글로벌 임상 3상을 완료했다. 알테오젠 역시 관련 물질 ‘ALT-L9’의 글로벌 임상 3상을 상반기 중 마무리한다는 계획이다. 셀트리온은 이미 자체 아일리아 바이오시밀러 ‘CT-P42’에 대해 미국과 EU, 한국, 캐나다 등에 허가 신청을 완료했다.
아일리아 바이오시밀러 개발 업계 관계자는 “애브비의 물질이 될 것이라고 아직 확답할 순 없지만, 4~5년 내 황반변성 유전자 치료 신약도 충분히 등장할 수 있으리라 판단한다”며 “다만 해당 약물은 고가로 접근성 이슈가 있을 것이다”고 운을 뗐다.
다른 동종 물질 개발 업계 관계자는 “유전자 치료제가 등장과는 별개로 고령층 증가와 맞물려 기존 항VEGF 시장 역시 더 커질 수밖에 없다”며 “시장 전환을 노리는 고용량 아일리아의 등장과 신개념 유전자 치료제의 개발 상황을 주시할 것이다. 우선 개발한 바이오시밀러부터 빠르게 시장에 내놓는 것이 급선무다”고 전했다.


![“270만원 화웨이 신상폰 살 수 있어요?” 中매장 가보니[르포]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112601335t.jpg)

![친누나 11차례 찔러 죽이려한 10대에...법원 “기회 주겠다” [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112700001t.jpg)
