|
최근 AI가 가장 영향을 주는 분야 중 하나는 구조생물학과 신약 개발 분야다. ‘챗GPT의 아버지’ 샘 올트먼 오픈AI 최고경영자(CEO)도 지난 17일(현지시간) 월드코인 개발사 툴스포휴머니티가 주최한 ‘새로운 세계(A New World)’ 행사에서 “과학자들이 AI를 사용해 자신들의 신약 개발 등에서 연구 속도를 높이고 있다는 말을 자주 듣는다”며 “의료 분야에서도 질병을 앓는 사람들이 증상을 AI에 입력해 진단을 받은 뒤 의사에게 정밀 치료를 받고 있고, AI가 과학을 가속화해 세계적인 문제를 해결하는 열쇠로 역할을 하고 있다”고 말했다.
◇단백질 구조 분석으로 인류 탄생 비밀까지
올해 노벨화학상의 주역인 알파폴드는 구글딥마인드에서 개발한 AI 시스템으로 단백질 구조를 예측하는 데 활용할 수 있는 유용한 도구다. 단백질을 구성하는 아미노산은 총 20종류로, 지난 1970년대부터 연구자들은 아미노산 서열에서 단백질 구조를 예측하기 위해 시도해 왔다. 그런데 알파폴드의 등장으로 4년 전부터 단백질 구조 분석과 예측에 획기적인 전환점이 마련돼 2억 개의 단백질 구조를 예측할 수 있게 됐다.
|
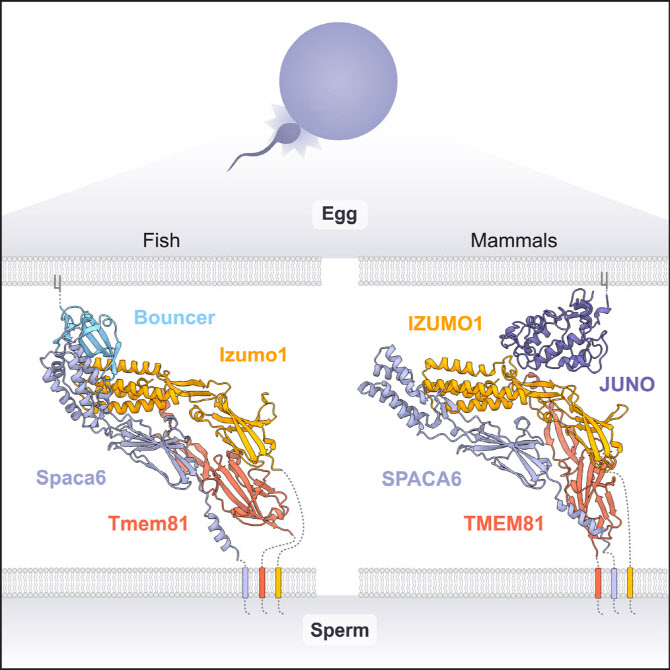
정자와 난자가 결합하는 과정에는 세포 지질막에 있는 단백질들이 관여하게 되는 이들의 상호작용이 일시적이거나 아주 희미한 수준에서 일어나 충분한 연구가 이뤄지기 어려웠다. 그동안 정자 표면에서 발견되는 ‘이즈모01’과 난자막에 위치한 ‘주노’ 만이 수정을 위해 결합하는 것으로 알려졌다. 그런데 알파폴드는 제브라피쉬를 이용한 실험에서 정자와 난자 사이의 분자적 결합을 쉽게 만드는 제3의 단백질을 찾아 기존 통념을 깼다. 안드레아 파울리 오스트리아 비엔나 분자병리학연구소 박사는 “세 가지 단백질 복합체를 식별한 것은 연구의 큰 진전”이라며 “이 자물쇠와 열쇠 과정이 얼마나 중요한지 식별했으며, 진화적 다양성으로 생명의 시작부터 보편적인 메커니즘을 확인했다”고 설명했다.
|
이처럼 AI의 발달은 전통 생물학 연구의 지평도 바꾸고 있다. 특히 과거 엑스레이나 핵자기공명분광기, 초저온전자현미경과 같은 장비를 이용해 단백질이나 단백질 복합체의 구조를 밝히는 구조 생물학에서 급격한 변화가 목격된다.
전문가들은 과거에는 AI로 예측한 단백질 구조가 실제 구조와 얼마나 비슷할지에 대한 의심이 있었지만, 기술 발달로 AI의 예측이 실제 단백질 구조와 비슷한 수준에 이르렀다고 보고 있다.
과거에는 실험을 설계하고 데이터를 만드는 데 시간이 오래 걸린 것은 물론 구조를 밝혀내기가 어려웠다. 그런데 최근에는 단순 단백질 예측만이 아니라 단백질 기능과 결합에 대한 연구가 빠르게 발전하는 추세다. 가령 특정 질병을 일으키는 단백질과 결합해 그 단백질을 억제하기 위한 저분자 화합물을 만들거나 자연에 없는 새로운 단백질을 설계할 수 있다. 필요한 기능 만을 갖추도록 인위적인 단백질을 만들 수도 있는 셈이다.
김동섭 한국과학기술원(KAIST) 바이오뇌공학과 교수는 “구조 생물학은 결국 실험을 통해 복잡한 단백질이나 DNA(데옥시리보핵산)· RNA(리보핵산)와 상호작용하는지를 알아야 하는데 알파폴드 같은 AI 모델이 출발점에서 모델을 만드는데 유용한 도구로 역할을 하고 있다”며 “AI가 과거 보조 수단이었다면, 이제는 기존 연구를 대체할 정도로 AI가 없으면 연구를 하기 어려운 시대가 됐다”고 설명했다.
이같은 연구는 신약 개발 등에서도 중요한 단서를 제공할 수도 있다. 김 교수는 “단백질 하나의 구조 만을 예측해 신약개발에 영향을 주는 것은 제한적”이라며 “하지만 단백질이 다른 생체 분자들과 어떻게 결합하는지 정확하게 예측하기 위한 연구들이 이어지면 공학 연구 분야 발전을 이끌 것으로 기대된다”고 덧붙였다.


![“270만원 화웨이 신상폰 살 수 있어요?” 中매장 가보니[르포]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112601335t.jpg)

![친누나 11차례 찔러 죽이려한 10대에...법원 “기회 주겠다” [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112700001t.jpg)
