|
12일 퓨쳐켐(220100)에 따르면 자사 파킨슨병 진단용 방사성의약품 ‘피디뷰’는 내달 미국 식품의약국(FDA)과 사전 임상계획승인(Pre-IND) 미팅이 예정돼 있다. 앞서 퓨쳐켐은 ‘피디뷰’의 미국 FDA 품목허가를 위해 미국 신시내티에 본사를 둔 ‘카마르고 파마슈티컬 서비스’(Camargo Pharmaceutical Service)와 임상시험수탁(CRO) 계약을 체결했다. 아울러 퓨쳐켐은 미국 임상을 위해 미국 콜롬비아 대학과 연구자 임상을 진행했다.
퓨쳐켐 피디뷰, 출시 6년 만에 국내 시장 100% 대체
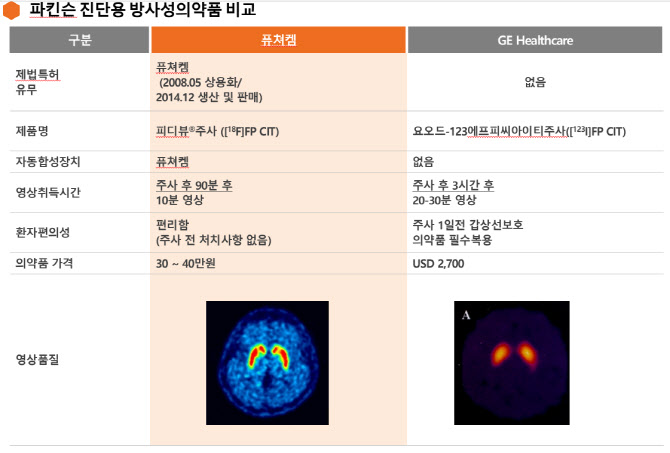
그동안 파킨슨병을 진단하기 위해선 ‘요오드 표지 의약품’(요오드-123 FP CIT) 주사 후 3시간 뒤, 원통 모형의 PET-CT에 들어가 20~30분간 촬영을 해야 했다. 그럼에도 얻어지는 영상품질은 만족스럽지 않고 가격마저 313만원(2700달러)으로 고가였다. 더욱이 약물 부작용 최소화하기 위해 요오드 주사 일주일 전부터 갑상선 보호 의약품을 복용해야 했다.
반면 퓨쳐켐의 피디뷰 주사는 요오드 주사제 가격의 1/10 수준인 30만~40만원에 불과하다. 그럼에도 영상은 비교 불가한 수준으로 고품질이다. 피디뷰는 주사 후 90분 후 10분간의 촬영만으로도 파키슨병 진단에 필요한 영상을 얻을 수 있다. 또 갑성성 보호 의약품 등의 주사 전 처치 사항이 전무하다.
퓨쳐켐은 피디뷰를 지난 2008년 5월 상용화에 성공했고 2014년 12월부터 생산·판매를 개시했다. 피디뷰는 국내 출시 6년 반 만에 기존 요오드 표지 방사성의약품 시장을 100% 대체했다.
퓨쳐켐 관계자는 “불소 기반의 요오드 표지 의약품은 제조 수율이 떨어져 대량 생산이 불가능하다”면서 “반면 피디뷰는 알코올에서 조영제 물질을 뽑아내는 기술을 보 유중이다. 기존 불소 기반 요오드 표지 의약품 대비 35배의 수율이 나온다. 피디뷰는 대량 생산이 가능해지면서 가격 경쟁력을 갖췄다”고 설명했다.
퓨쳐켐은 알코올 용매를 이용해 F-18 방사성 동위원소를 뽑아내는 특허를 17개국에 출원·등록했다. 이 기술은 해외에서도 인정받아, 독일 바이엘사는 지난 2007년 12월 퓨쳐켐과 기술이전 계약으로 사들였다.
|
더욱이 지난해 9월 PET-CT 검사비가 건강보험 비급여에서 선별급여로 전환되면서, 환자 부담금은 60만원에서 26만7000원으로 줄어들었다. 여기에 파킨슨병 치료제마저 건강보험으로 200만원에서 9만원 수준으로 대폭 낮아짐에 따라 국내 파킨슨병 검사·치료제 시장이 빠르게 확대되고 있다. 퓨쳐켐이 최근 매분기 전년동기 대비 30% 이상의 고성장을 기록하고 있믄 배경이다. 퓨쳐켐은 지난 3년간 매출액은 56억원(2018년) → 82억원(2019년) → 110억원(지난해) 순으로 확대됐다. 특히 분기별 매출액은 지난 4분기 45억원, 올 1분기 33억원 등으로 가파르게 상승 곡선을 그리고 있다.
올해 국내에서 PET-CT를 통해 파킨슨병 진단 검사 환자는 약 58만명으로 예상되고, 시장 규모는 1740억원 규모로 추산된다.
“FDA 패스트트랙 통해 2년 내 1억달러 규모 美 진출”
퓨쳐켐은 국내에서 파킨슨병 진단 시장에서 경쟁자 없는 1위 사업자로 올라서면서 세계 시장으로 보폭을 확대하고 있다. 한국을 제외한 모든 국가가 아직까지 파킨슨 진단에 요오드 표지 의약품을 쓰고 있기 때문이다.
퓨쳐켐 관계자는 “FDA 505(b)2 패스트 트랙을 활용해 피디뷰 품목허가를 신청할 계획”이라며 “기존 승인된 약물이 있는 경우 중복 자료를 면제해 임상 1상만으로 품목허가가 가능한 제도다. 현재 임상 없이 NDA를 신청할 수 있도록 진행 중이다. FDA가 임상을 요구할 경우 임상 1상 정도로만 할 수 있도록 노력 중이다. 피디뷰는 2년 내 미국 시장 진출이 가능할 것으로 예상한다”고 말했다.
그는 “미국 FDA 승인받으면 유럽의약품청(EMA)은 행정절차만으로 승인이 가능해진다”며 “아시아, 중동 남미 등은 기술이전 계약 추진을 통해 시장 확대를 꾀할 계획”이라고 밝혔다.
미국 내 요오드 표지 의약품 시장은 연간 1억달러(1161억원) 규모다. 퓨쳐켐은 국내에서 요오드 표지 방사성의약품이 피디뷰 출시 후 100% 대체됐던 전례가 미국에서도 재현될 것으로 기대하고 있다.
퓨쳐켐 관계자는 “미국은 아직까지 요오드 표지 의약품이 널리 사용되고 있다”면서 “피디뷰는 해당 의약품 대비 가격경쟁력이 높고 퀄리티는 높은 영상을 빠르게 취득할 수 있어 출시 후 빠르게 기존 시장을 대체해 나갈 것으로 자신한다”고 말했다.





![“명품인 줄” 이부진, 아들 졸업식서 든 가방…어디 거지?[누구템]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021100594t.jpg)
![현대건설마저 떠났다…한수공 1.2조 조지아 수력사업 ‘안갯속' [only 이데일리]](https://image.edaily.co.kr/images/Photo/files/NP/S/2026/02/PS26021101791t.800x.0.jpg)

