업계에서는 핀테플라와 같은 적응증을 가진 ‘카리스바메이트’의 글로벌 임상 3상을 진행 중인 SK바이오팜(326030) 역시 같은 등급을 받을 것으로 예상한다. 해당 물질이 1번 3상에 실패하고 약물재창출을 시도한 만큼 효능 입증이 관전이라는 분석도 제기되고 있다.
|
핀테플라, 스케쥴 등급 완화...“처방 확대 기대”
25일 제약바이오 업계에 따르면 뇌전증 치료제와 같이 중추신경계에 작용하는 약물이 미국에서 출시되려면, DEA로부터 오남용 및 약물의존도 등을 평가 받아야한다. DEA는 그 결과는Ⅰ부터 Ⅴ까지 5단계의 스케줄 등급으로 구분한다. V등급이 가장 오남용 위험이 낮은 것으로 알려졌다.
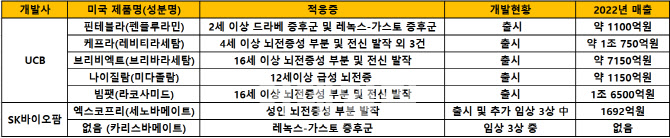
UCB의 ‘핀테플라’(성분명 펜플루라민)는 기존에 스케줄 Ⅳ등급으로 분류됐다. 이에 따라 최대 처방기간은 6개월이며, 처방전 역시 전산 처리가 아닌 수기로 작성해야 하는 상황이었다. 하지만 이번에 그 등급이 완화된 것으로 단회 처방기간은 1년으로 늘고 전산처리도 가능해 현장에서 쉽게 취급할 수 있게된 것이다.
브래드 채프먼 UCB 미국 부문 대표는 “핀테플라에 대한 규제 완화로 수기 처방전에 대한 부담이 없어져 취급이 편해질 것이다. 시장성도 한층 더 높아질 것”이라고 기대했다. 지난해 핀테플라의 매출은 7470만 유로(한화 약 1100억원)였다.
국내 뇌전증 신약 개발 분야 한 연구자는 “핀테플라는 향정신성의약품인 암페타민 유도체 계열약으로 중추신경 흥분과 식역 억제 기능 등이 알려졌다”며 “이에 대한 우려가 반영됐다가 실사용한 결과를 바탕으로 이를 해제한 것”이라고 조언했다.
UCB는 지난해 미국 조제닉스를 인수하며 핀테플라를 확보했다. 핀테플라의 성분인 펜플루라민의 대사산물인 뇌 속에서 세로토닌 과활성화를 억제해 뇌전증 증상을 완화하는 것으로 알려졌다. 핀테플라는 미국에서 2020년 2세 이상 드라베 증후군 환자 적응증으로 승인됐다. 이후 2022년 2세 이상 소아의 레녹스-가스토 증후군 관련 적응증도 확대 승인받기도 했다.
핀테플라의 적응증인 드라베 증후군과 레녹스-가스토 증후군은 생후부터 7세까지 소아기 때 나타나는 대표적인 난치성 희귀 질환이다. 드라베 증후군은 영아 때 나타나며, 신경 퇴화로 이어진다. 매우 심한 발작 증상을 보이는 레녹스-가스토 증후군은 2~6세 때 나타나며, 세계적으로 약 1000만 명의 환자가 있는 것으로 알려졌다. 학계에 따르면 이 두 가지 희귀 뇌전증 질환을 앓았던 소아의 80%가 성인이 돼서도 같은 증상을 겪는 것으로 보고되고 있다.
UCB에 따르면 핀테플라의 규제등급 제한이 완화되면서 회사가 보유한 약물 중 나이질람만 스케줄 Ⅳ등급이다. 나머지는 모두 V등급으로 현장 활용도가 높은 것으로 확인됐다. 회사는 현재 핀테플라를 비롯해 △16세 이상 뇌전증성 부분 및 전신 발작 치료제 ‘빔팻’(성분명 라코사미드) △4세 이상 뇌전증성 부분 및 전신 발작 치료제 ‘케프라’(성분명 레비티라세탐) △16세 이상 부분 및 전신 발작 치료제 ‘브리비엑트’(성분명 브리바라세탐) △12세 이상 나이질람(성분명 미다졸람) 등을 보유하고 있다. 회사는 지난해 이들 5종의 뇌전증 약물로 24억9020만 유로(한화 약 3조5000억원)의 매출을 올리며 세계 시장을 주름잡고 있다.
|
SK바이오팜 ‘카리스바메이트’, 2025년 핀테플라와 맞대결 준비
대한소아신경학회에 따르면 뇌전증 유병율은 전체 인구의 약 0.5~0.1%로 세계적으로 약 7000만 명 정도가 해당 질환을 앓고 있는 것으로 추산된다. 또 전체 환자의 30%가 4세 이하, 75%가 성인이 되기 전에 발병한다. 뇌전증 치료제의 접종 연령을 소아 이상으로 확대해야 세계 약 7~8조원 규모의 뇌전증 시장에서 의미있는 점유율을 확보해 나갈 수 있다는 얘기다.
UCB를 추격하는 국내 대표 기업이 SK바이오팜이다. 회사는 레녹스-가스토 증후군 대상 후속 신약 ‘카리스바메이트’의 개발 성공과 ‘엑스코프리’(성분명 세노바메이트, 유럽제품명 온투즈리)의 소아 적응증 확대 등 투트랙 전략을 수행하고 있다. 두 가지 전략의 개발 단계는 모두 임상 3상으로, 2025년 미국 내 출시 및 적응증 확대 성공을 목표로 하고 있다.
우선 SK바이오팜은 지난해 1월 미국과 유럽 등 60개 기관에서 ‘카리스바메이트’의 글로벌 임상 3상에 돌입했다. 카리스마메이트는 뇌전증 치료제로 쓰이던 펠바톨의 유도체다. 기존 펠바톨의 부산물로 간독성과 빈혈 부작용을 독성대사산물이 생산되지 않도록 카리스마메이트를 디자인한 것으로 알려진다. 전임상 등에서 레녹스-가스토 증후군 뿐만아니라 뇌전증성 2차성 전신발작 등에서도 효능이 확인한 바 있다.
앞선 연구자는 “기존에 펠바톨 성분의 약물이 DEA로부터 스케줄 5등급을 받았었다”며 “그 유사체인 카리스바메이트 역시 승인된다면 같은 스케줄 등급을 받을 가능성이 높다”고 설명했다. 이어 “핀테플라나 카리스바메이트 모두 경구용 현탁액 방식이다. 결국 효능 면에서 카리스바메이트가 핀테플라를 넘어서야만, 향후 2년간 시장을 확대한 핀테플라와 경쟁할 수 있을 것”이라고 말했다.
UCB에 따르면 핀테플라는 레녹스-가스토 증후군 환자의 발작발생을 감소시키는 비율이 23.7%로 위약군(8.7%) 대비 약 2.8배 높았다. 카리스바메이트가 이보다 높은 효능을 보여야 한다는 의미다. 카리스바메이트는 과거 미국 존슨앤존슨(J&J)에게 기술수출돼, 기존 뇌전증 적응증으로 임상 3상을 진행했다가 유효성 입증에 실패한 바 있다. J&J으로 부터 카리스바메이트의 기술을 전부 반환받은 SK바이오팜은 이를 약물재창출하기 위해 역량을 쏟아 붓는 중이다.
이밖에도 SK바이오팜은 2019년 미국에서 성인의 부분발작 치료제로 엑스코프리를 승인받았다. 이듬해인 2020년 3월 DEA로부터 스케쥴 V등급을 받아 본격 출시했고, 지난해 1692억원의 매출을 기록했다. 현재 소아 이상 환자의 뇌전증성 부분발작 및 성인의 전신발작 치료제로 적응증을 확대하기 위한 엑스코프리의 미국 내 추가 임상 3상을 진행하고 있는 것으로 알려졌다. 회사 측은 “카리스마메이트 허가 및 엑스코프리의 적응증 확대 성공 시점을 모두 2025년으로 잡고 있다”며 “뇌전증 시장의 선두기업으로 올라서기 위해 노력해 갈 것”이라고 전했다.








![쇼핑성지 옛말, 상가 통으로 '임대' 딱지…"팔 수 있다면 20억도 깎죠"[르포]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031100390t.jpg)
![서초구 아파트 19층서 떨어진 여성 시신에 남은 '찔린 상처' [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031100013t.jpg)