코로나 치료제와 백신이 개발됐지만, 감염병을 정확하고 빠르게 진단하는 진단기술이 무엇보다 중요하다. 한국바이오협회 ‘신종 바이러스 감염병 팬데믹 대응을 위한 차세대 진단기술’ 리포트를 통해 감염병 진단기술에 대해 알아본다.
PCR 기반 핵산 검출
PCR은 효소 복제를 통해 시험관 내 특정영역이 핵산을 기하급수적으로 증폭하는 중요한 생화학 및 분자 생물학 기술이다. 특히 코로나19 바이러스와 같은 리보핵산(RNA) 바이러스는 실시간 역전사 중합효소연쇄반응(qRT-PCR) 진단법이 사용되고 있다. 해당 진단법은 정확도가 면역진단방법 대비 높지만, 장비의 소형화와 진단시간 단축에 제약이 있다. 전문 진단설비를 갖춘 대형병원이나 임상검사실에서만 사용이 가능하다.
|
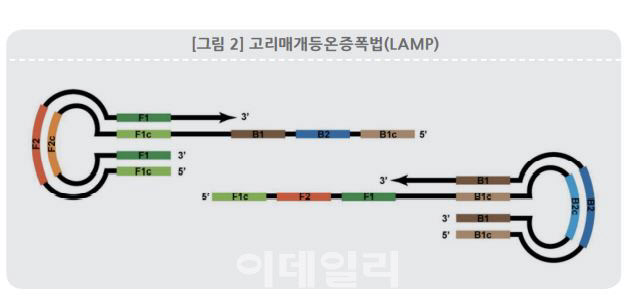
일정 범위 온도(60~70도)에서 DNA를 증폭시키는 고리매개등온증폭(LAMP) 기술은 열 순환 과정을 단순화하고 분석 시간을 줄이기 위해 개발된 기술이다. PCR보다 빠르게 DNA를 증폭할 수 있다. 코로나 바이러스를 검출하기 위해 ‘역전사고리매개등온증폭법(RT-LAMP)’이라는 기술을 개발했다. RT-PCR과 비슷하게 환자 타액이나 코, 목구멍 등에서 검체를 채취해 특정 코로나 바이러스 유전자를 식별해 감염 여부를 판별한다. 1시간 내 진단이 가능하다는 장점이 있지만 분석 설계가 RT-PCR 대비 복잡하고 추가 최적화가 필요하다.
바이러스 항원 면역학적 검사
뉴클레오캡시드(nucleocapsid, N) 단백질은 코로나바이러스에서 가장 풍부한 단백질이며 SARS-CoV 검출을 위한 진단 마커로 사용할 수 있다. 비인두 흡인물, 소변 및 대변 등에서 검출이 가능하다. 바이러스 항원은 면역조직화학(IHC) 및 효소 결합 면역흡착 분석(ELISA)과 같은 일반
적인 단백질 검출 기술로 검출할 수 있다. 특히 ELISA는 비용 효율성과 작동 용이성으로 인해 실험실 단백질 검출에 널리 사용되고 있다. 바이러스 항원 검사는 qRT-PCR 시스템을 사용할 수 없을 때 경제적이고 편리한 진단 방법으로 꼽힌다. 하지만 위양성 및 위음성이 높아 특이도 및 민감도가 낮다는 한계가 있다.
항원/항체 현장검사
혈청학적 검사는 항원 단백질 또는 체내에서 생성된 항원에 대한 항체를 측정하는 방식이다. 일반적으로 혈액에서 IgM 및 IgG를 검출한다. 특히 측면 유동 면역분석법(LFIA)은 항원을 검출하는 방법과 항체를 검출하는 방법으로 나눌 수 있다. 항원검사법은 ELISA의 Sandwich 법과 원리가 동일하다. 감염뿐만 아니라 환자 회복 상태 추정, 치료 효과, 역학 조사, 백신 유용성 등을 평가하는 데 사용될 수 있다. 과정이 단순하고 고가 장비가 필요치 않다. 항원 또는 항체 존재 여부도 15분 이내 알 수 있어 최적의 현장검사법이 될 수 있다. 하지만 무증상 감염자에 대한 민감도가 떨어지고 항체 현장검사는 감염 초기 진단이 어렵다는 단점이 있다.
|
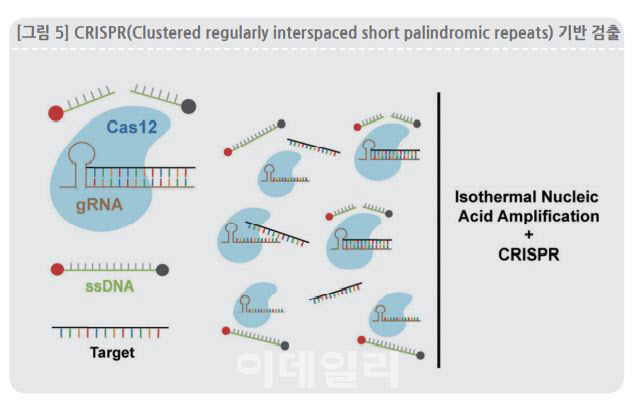
최근에는 크리스퍼(CRISPR) 유전자 가위 기술을 이용한 진단기술이 차세대 유망기술로 손꼽히고 있다. 미국 신생 바이오벤처인 셜록바이오사이언스가 개발한 유전자가위를 이용한 기술 SHERLCOK이 대표적이다. 유전자가위는 유전정보를 담고 있는 리보핵산(RNA)을 잘라낼 수 있다. 잘라낼 RNA에 형광물질을 달아 놓은 뒤 코로나바이러스를 인식했을 때 이 RNA를 자르도록 조건을 설정해두면 코로나바이러스가 있을 때만 형광물질이 떨어져 나가는 방식으로 진단키트를 만들 수 있다.
즉, 크리스퍼 유전자 가위가 코로나19 바이러스를 식별할 경우 이 유전자를 절단하도록 하는 동시에 형광분자 신호를 생성하도록 만들어 감염 여부를 판별할 수 있는 기술이다. 우수한 분석 감도와 민감도를 가져 임상 진단에서 위양성 및 위음성을 최소화 할 수 있기 때문에 높은 관심과 기대를 받고 있다.
국내에서는 글로벌 유전자 가위기업으로 평가받고 있는 툴젠이 지난 2017년 분자진단에 적용할 수 있는 크리스퍼 유전자가위 기술 특허를 등록했다. 또한 분자진단 전문기업 바이오니아(064550)와 크리스퍼 유전자가위 기술이전 계약을 체결했다. 이 외 지플러스생명과학과 엔세이지가 코로나19 등 진단키트 개발에 나서고 있다.






![“덩치 큰 남성 지나갈 땐”…아파트 불 지른 뒤 주민 ‘칼부림' 악몽[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031000001t.jpg)

