|
13일 제약·바이오업계에 따르면 산업통상자원부 한국산업기술평가관리원(KEIT)의 ‘글로벌 경쟁력 확보 가능한 동물유래성분대체(AoF) 배양배지 기반 고도화된 줄기세포치료제 임상시료 제조기술 개발’ 국책과제의 제2 세부과제인 ‘임상용 중간엽줄기세포 치료제 맞춤형 동물유래성분대체 배양배지 기술 개발’을 비욘드셀이 주관한다. 과제 기간은 지난 9월 1일부터 2026년 12월 31일까지 3년 4개월이다.
비욘드셀은 아미코젠과 미국 아티아바이오가 각각 60%, 40%의 지분을 보유한 조인트벤처다. 비욘드셀은 배양배지 연구개발 및 영업을, 아미코젠은 배양배지 생산을 각각 전담한다.
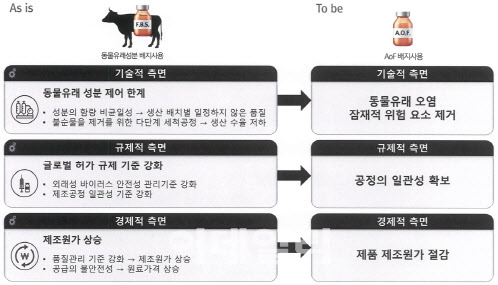
배지는 바이오의약품 생산에 사용되는 세포주의 먹이다. 배지는 △1세대 소 태아 혈청 배지 △2세대 무혈청 배지 △3세대 화학조성(동물유래성분대체) 배지로 구분된다. 소 태아 혈청 배지는 혈청의 화학적 조성이 확인되지 않아 바이오의약품의 생산에 사용될 경우 분리정제 공정 및 품질관리에 어려움을 준다. 최종 의약품에 잠재적 감염요소가 될 수 있는 동물 유래 바이러스나 광우병 인자 등이 포함될 가능성도 있다. 여기에 살아 있는 소의 태아에서 혈액을 채취하므로 윤리적 이슈까지 얽혀 소 혈청 배지의 사용은 점차 축소되는 추세다. 이를 보완해 나온 것이 무혈청 배지이지만 이는 혈청 배지 대비 세포 성장 속도가 느리고 대량생산이 어렵다는 단점이 있다.
카티스템은 국내에서만 연간 200억원의 매출을 내고 미국 및 일본 진출을 위해 임상 3상을 준비 중인 무릎골관절염 치료제다. 메디포스트는 현재 소 태아 혈청 배지를 해외 글로벌 기업으로부터 전량 공급받아 카티스템 등에 사용하고 있다. 만약 배지를 화학조성 배지로 교체한다면 기술적·규제적·경제적 측면에서 경쟁력을 확보할 수 있다는 게 메디포스트의 설명이다.
메디포스트 관계자는 “화학조성 배지를 적용할 경우 동물유래 배지(1·2세대 배지) 사용 시 받아야 할 동물유래 바이러스 테스트 등 강화된 글로벌 규정에 따른 테스트 비용(원가의 약 35%)을 절감할 수 있다”며 “원가절감을 통해 이익을 극대화하고 타사 제품과 달리 동물유래 위험요소를 배제한 치료제가 됨으로써 경쟁력을 강화할 수 있다”고 설명했다. 카티스템의 경쟁약물인 베리셀의 ‘매시’나 일본 티슈 엔지니어링의 ‘자크’는 동물유래 배양배지를 사용한다.
아미코젠, 항체의약품서 줄기세포치료제로 무대 확대
|
아미코젠 관계자는 “세포주에 맞는 배지를 공급하기 위해서는 수요기업과의 신뢰관계가 중요한데 과제를 통해 초기 단계부터 함께함으로써 신뢰를 쌓아갈 수 있게 됐다”며 “이번 과제를 통해 세포치료제 맞춤형 화학조성 배지가 개발된다면 메디포스트뿐만 아니라 다양한 세포치료제 회사로도 배지를 공급할 수 있는 길이 열릴 것”이라고 말했다.
메디포스트 관계자도 “이번 국책과제 진행 과정이나 종료 후 비욘드셀 및 엑셀세라퓨틱스와의 추가적인 협업이 진행될 수 있다”고 했다. 이번 과제 성공 여부 및 메디포스트와의 향후 협업 여부에 따라 카티스템을 레퍼런스로 아미코젠이 글로벌 시장에 진출할 수도 있다.
참여기업에 이름을 올린 엑셀세라퓨틱스와의 시너지도 기대된다. 엑셀세라퓨틱스는 세계 최초로 cGMP등급 줄기세포용 화학조성 무혈청배지(hMSC)를 개발한 회사다. 경기도 용인에 연 10만ℓ의 배지 생산이 가능한 공장을 운영하고 있지만, 연내 완공 예정인 아미코젠의 배지 공장(연 400만ℓ 규모)에 비하면 그 규모가 작다. 엑셀세라퓨틱스의 기술력과 아미코젠의 대규모 생산설비를 활용한 또 다른 협업도 기대해 볼 수 있는 대목이다.