|
UCB, 베링거, 릴리 등 건선 혁신 신약 개발 열풍
18일 업계에 따르면 건선 치료를 위한 IL 억제 계열 혁신 의약품을 개발 중인 곳은 UCB과 독일 베링거인겔하임, 미국 일라이릴리(릴리) 등이다.
이중 가장 앞선 곳이 UCB다. 회사 측이 보유한 ‘빔젤스’(성분명 비메키주맙)는 인간화 단일클론항체로 IL-17A와 IL-17F 등을 동시에 차단한다.
UCB는 지난해 8월 성인의 중증도에서 중증의 판산 건선 신약으로 유럽의약품청(EMA)로부터 빔젤스의 판매 승인을 획득했다. 이후 올해 3월까지 이 약물은 일본, 캐나다, 호주 등 의약당국으로부터 건선 관련 적응증으로 추가로 허가를 받았다.
16일(현지시간) 미국 식품의약국(FDA)은 빔젤스의 승인을 보류했지만, 승인 전 실사 미비 사항을 지적했을 뿐이다. UCB 측은 FDA와 실사 관련 업무 절차를 협의 진행한 뒤, 연내 빔젤스에 대한 판매 승인을 얻어내는 것을 목표로 하고 있다. 올해 중 자사 약물에 대한 세계 주요 의약 당국의 승인을 모두 획득한다는 구상이다.
지난해 6월 학술정보조사업체인 클래리베이트 애널리틱스는 빔젤즈를 2025년 내 10억달러(한화 약 1조 1300억원) 매출을 넘어설 차세대 블록버스터로 선정한 바 있다.
베링거인겔하임의 IL-36 억제 약물 ‘스페솔리맙’도 차세대 혁신 건선 신약으로 꼽힌다. 현재 기존 약물이 갖지 못한 전신 농포성 건선 관련 적응증으로 임상 2상을 진행하고 있으며, 지난해 FDA와 식품의약품안전처 등이 혁신 치료제로 지정한 바 있다. 또 릴리가 플라크 건선 관련 적응증으로 임상 3상을 진행 중인 ‘미키리주맙’ 역시 차세대 주자로 알려졌다.
“IL 계열 약물 경쟁 치열...적응증 확장 및 차별화가 관건”
글로벌 시장조사업체 포춘 비즈니스 인사이츠는 건선 치료제 시장이 2019년 200억9000만달러(한화 약 25조5340억원)에서 2027년 405억8000만달러(한화 약 51조 5770억원)로 2배 이상 성장할 것으로 내다봤다.
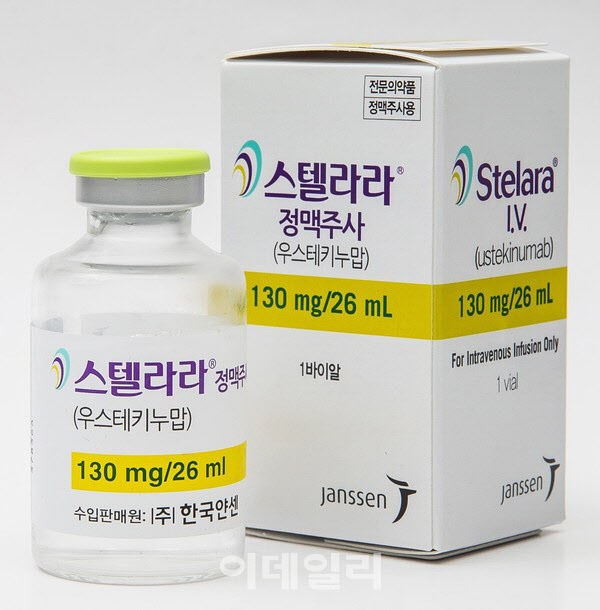
현재 이 시장을 주름잡는 IL 계열 약물은 스텔라라다. 바이오 전문매체 ‘드럭 디스커버리 앤 디벨럽먼트’에 따르면 지난해 스텔라라는 91억3400만 달러(한화 약 11조6090억원) 어치가 팔리며, 전체 의약품 중 매출 순위 9위에 이름을 올렸다. 이 약물은 IL-12 및 IL-23 등을 동시 타깃하며, 현재 크론병과 궤양성 대장염, 판산 건선, 건선 관절염 등 4종의 염증 관련 적응증을 보유하고 있다.
스텔라라의 대항마로는 코센티스(IL-17억제)를 비롯해 얀센의 ‘트렘피어’(성분명 구셀쿠맙, IL-23 억제), 릴리의 ‘탈츠’(성분명 익세키주맙, IL-17 억제), 미국 애브비의 ‘스카이리치’(성분명 리산키주맙, IL-23 억제) 등이 있다. 흔히 스텔라라를 1세대, 나머지를 2세대 IL 억제 약물이라 부른다.
업계 관계자는 “IL 계열 약물 중 스텔라라와 코센티스, 탈츠 등이 적응증을 4개 이상씩 장착하며 국내외에서 치열하게 경쟁 중이다”며 “새로운 IL-계열 신약이 얼마나 많은 염증 관련 적응증을 확보하는지가 시장 경쟁력을 갖출 핵심 요인이 될 것”이라고 말했다. 실제로 스카이리치도 최근 국내외에서 건선에 이어 건선 관절염까지 적응증을 2개로 늘리는 데 성공했고, FDA에 크론병 관련 적응증을 추가하기 위한 심사를 받고 있는 것으로 알려졌다.
그는 이어 “애브비의 휴미라처럼 종양괴사인자(TNF) 억제 계열의 약물도 건선을 포함한 염증 관련 적응증을 10개 이상 확보했다”며 “개발 중인 신약 중 베링거 인겔하임의 스페솔리맙처럼 기존 건선 치료제가 확보하지 못한 적응증을 갖는 것도 경쟁력으로 작용할 수 있을 것”이라고 말했다.
|
스텔라라 바이오시밀러, 5곳이 임상 3상 中
한편 스텔라라의 미국과 유럽 등 주요국 내 물질 특허가 각각 2023년 9월과 2024년 7월에 만료된다.
미국 암젠(ABP-654)과 독일 포마이콘(FYB202), 셀트리온(CT-P43), 동아에스티(DMB-3115), 삼성바이오에피스(SB17) 등 국내외 여러 제약사가 판산 건선을 적응증으로 스텔라라 바이오시밀러 후보물질의 글로벌 임상 3상을 진행하고 있는 이유다.
바이오시밀러 개발 업계 관계자는 “스텔라라가 처음으로 얻은 적응증이 판산 건선이다. 이를 대상으로 물질을 입증할 계획이다”며 “현재까진 얀센이 추가 용도를 더해 스텔라라의 특허를 연장하는 움직임은 확인되지 않았다. 관련 바이오시밀러를 내년 하반기 중 미국에서 출시할 수 있을 것으로 전망 중이다”고 말했다.

![삼성전자, 18만원도 뚫었다…사상 최고가 또 경신[특징주]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021300592t.jpg)


