|
바이오솔루션은 이번 국내 임상 3상 데이터로 미국 식품의약국(FDA)과 협의를 통해 임상 2상 후 조건부 품목허가를 신청하는 방안을 논의 중이다. 카티라이프는 미국에서 임상 2상을 진행 중이며, 마지막 환자 투여를 앞두고 있다. 최종 결과는 이르면 내년 말 나올 예정이다. 특히 지난 8월 FDA로부터 첨단재생의학치료제(RMAT)로 지정된 만큼, 신속한 심의를 기대할 수 있다는 설명이다.
이정선 바이오솔루션 사장은 “희귀의약품은 아니지만 현재 협업 중인 미국의 임상 컨설팅 업체에서 조건부 허가 가능성이 있다고 한 상황”이라며 “카티라이프는 RMAT으로 지정돼 있어 신속심사대상이다. FDA로부터 맞춤식 조언을 얻을 수 있기 때문에 허가 과정에서도 빠르게 승인을 얻을 수 있다. 일단 FDA와 미팅을 하고 조건부 품목허가를 신청할지, 임상 3상을 진행할지 결정할 것”이라고 말했다.
카티라이프는 환자 본인의 세포를 채취해 배양한 다음 다시 이식하는 시술이다. 흔히 비교되는 메디포스트(078160)의 카티스템은 제대혈에서 추출한 타인의 줄기세포를 무릎에 이식하여 연골을 재생시키는 시술이다. 엘앤씨바이오(290650)의 ‘메가카티’는 동종 인체 유래 연골인 초자연골을 무세포화해 연골 병변에 직접 이식하는 방식이다. 메가카티는 치료제가 아닌, 의료기기로 분류돼 있다.
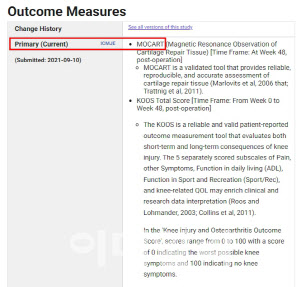
바이오솔루션은 임상 2상 환자들을 대상으로 5년 추적 결과도 논문으로 게재할 예정이다. 지난 2020년 임상 1상 환자 대상 5년 추적 결과를 발표한 데 이어 두 번째다. 주목할 부분은 MRI 촬영을 통해서만 확인되는 객관적인 연골 재생 평가지표 ‘MOCART’ 점수를 통해 구조적인 연골 재생을 확인했다는 점이다. MOCART 점수는 MRI를 바탕으로 구조적 재생과 관련된 9가지 항목(결손부위 채워짐 정도, 주변조직과 연결성, 재생조직 표면, 구조, 신호강도, 연골하골 상태, 활막염 등)을 평가한 결과다.
|
바이오솔루션은 카티라이프의 연골 재생 효능을 입증한 만큼 글로벌 골관절염 치료제 시장에서 다크호스가 될 것으로 기대하고 있다. 이미 입소문이 나면서 지난해 시술 건수는 약 130건, 올해 약 200건을 기록했다. 내년에는 500건 수준으로 수요는 계속 늘어날 것으로 평가한다. 카티라이프의 수술 비용은 약 1500만원으로 알려져 있다.
이 사장은 “올초에 원료 공급 부족이 나서 한 달 정도 영업을 하지 못했을 정도로 수요가 늘고 있다”며 “특히 중소형 병원보다 대학병원에서 더 많이 쓴다. 대학병원에서 쓰기 시작하면서 2차 병원으로 퍼지고 있다”고 말했다.