이런 특허덤블을 근거로 J&J은 미국 암젠과 같은 주요 스텔라라 시밀러 개발사와 수년전부터 막판 소송전을 벌이는 상황이었다. 그런데 최근 암젠을 비롯한 아일랜드 알보텍, 독일 포마이콘 등이 J&J이 구축한 스텔라라 관련 특허덤블에 대한 합의에 도달하고 있다. 이들은 가장 큰 시장인 미국에서 스텔라라 시밀러의 출시 가능 시기를 늦어도 2025년 상반기로 확정했다.
스텔라라 시밀러에 대한 주요국내 품목허가를 속속 신청한 셀트리온(068270)과 동아에스티(170900) 등 국내사의 특허덤블 극복 전략에 관심이 쏠리는 이유다. 양사는 모두 특허덤블 회피 전략 또는 합의 가능성에 대해 함구하면서, “글로벌 기업에 뒤쳐지지 않게 출시할 수 있도록 준비하고 있다”고 자신하고 있다.
|
총대 멘 ‘암젠’, 뒤따르는 ‘알보텍·포마이콘’
스텔라라는 인터류킨-12와 IL-23을 동시에 억제하는 기전을 가졌다. 2008~2009년 사이 캐나다와 EU, 미국 등에서 중증도~중증의 판산 건선 치료제로 승인된 약물이다. 최근까지 건선 관절염, 크론병, 궤양성 대장염 등의 적응증을 획득했다.
2022년 기준 스텔라라 의 매출은 97억 달러(당시 한화 약 12조원)로 J&J이 보유한 약물 중 가장 높은 판매고를 올렸다. 특히 스텔라라 전체 매출의 약 60%(63억8800만 달러)가 미국 시장에서 나왔다. J&J은 후발주자의 진입을 막아서기 위해 해당 시장 내에서 스텔라라에 대한 특허덤블을 이미 구축해 놓은 것으로 알려졌다.
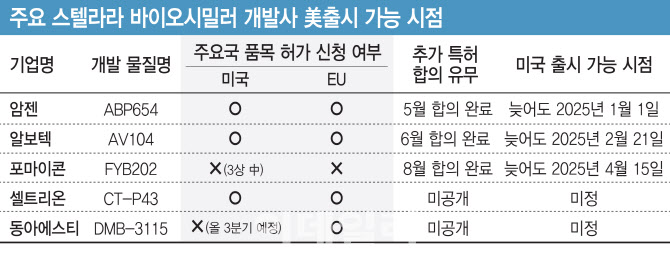
글로벌 제약바이오 기업 중 스텔라라 시밀러 후보물질에 대해 임상 3상 이상 단계에 올라 있는 곳은 암젠과, 알보텍, 포마이콘, 인도 바이오콘, 중국 바이오테라솔루션 등 5곳이다.
지난해 암젠이 가장 먼저 스텔라라 시밀러 ‘ABP654’ 임상 3상을 마치고, 미국식품의야국(FDA) 등에 허가 신청서를 제출했다. 회사 측은 ABP654를 ‘인터체인저블(상호교환성) 시밀러’로 승인받기 위한 임상 3상도 지난 2월 마친 바 있다. 이를 막아서기 위해 J&J은 지난해 12월 “암젠 측이 스텔라라의 궤양성 대장염 적응증 관련 2건의 자사 특허를 침해했다”며 소송을 제기했다.
그런데 지난 5월 J&J과 암젠의 공방전이 최종 합의를 통해 봉합되며 막을 내렸다. 이로써 암젠은 늦어도 2025년 1월 1일까지 ABP654를 출시할 수 있게 됐다. 지난 6월에는 알보텍이 스텔라라 시밀러 ‘AVT04’와 관련해 J&J과 오리지널 특허에 대한 합의에 도달했다. 알보텍은 지난 1~2월 사이 미국식품의약국과 유럽의약품청의 ‘AVT04’의 품목허가를 신청한 바 있다. 회사에 따르면 2025년 2월 21일 이전에 해당 제품을 출시할 수 있도록 협상을 타결했다고 발표했다.
여기에 지난 7일(현지시간) 독일 포마이콘도 자체 개발한 스텔라라 시밀러 후보 ‘FYB202’를 늦어도 2025년 4월 15일 이전에 출시할 수 있도록 J&J과 합의했다고 발표했다. 이 같은 합의를 통한 출시 기한이 2025년 상반기경으로 결정되면서, 오는 9월 스텔라라의 물질특허가 만료되더라도 1년 이상 관련 복제약이 등장하지 않을 수도 있다는 얘기다.
|
셀트·동아ST, 허가 심사 속속...“특허회피 전략 미공개”
국내에선 셀트리온이 8월 기준 스텔라라 시밀러 후보물질 ‘CT-P43’에 대해 EU와 캐나다, 미국, 한국 등에서 품목허가 신청을 완료했다. 셀트리온이 스텔라라 시밀러 개발사 중 세 번째로 주요국에 관련 후보물질의 허가 신청을 마친 것이다.
셀트리온 관계자는 “특허 관련 전략을 한국 기업이 그동안 일부 공개했던 부분들에 대해, 항간에서는 ‘따로 알아볼 필요도 없다’며 반색하는 분위기도 있었다”며 “경쟁사를 고려해 우리도 충분히 발표할 시기가 되기 전까지 모든 내용을 공개하지 않을 방침이다”고 설명했다. 이어 “다만 경쟁 물질에 뒤지지 않도록 준비가 진행되고 있다”고 말했다.
지난달 유럽의약품청(EMA)은 동아에스티가 개발한 스텔라라 시밀러 ‘DMB-3115’에 대해 품목 허가 심사를 개시했다. 회사 측은 3분기 중 FDA에 관련 허가 신청서를 제출할 예정이다.
미국이나 유럽에서 DMB-3115의 허가 절차는 2021년 관련 권리를 기술이전받은 인도 인타스 파마슈티컬스(인타스)가 주도하고 있다. 동아ST 관계자는 “글로벌 상황과 관련해 인타스와 협의를 통하고 있고, 특허 등에 대한 언급은 인타스가 특히 민감하다. 현재로선 따로 밝힐 부분은 없다”고 일축했다.
FDA나 EMA의 시밀러 허가심사 기간이 약 10개월인 것을 고려하면, 내년까지 최소 4종의 스텔라라 시밀러 후보물질에 대한 심사 결론이 도출될 수 있는 상황이다.
시밀러 개발업계 또다른 관계자는 “해외사들의 합의를 보면 ‘늦어도 2025년’이라는 표현들이 나오지만, 당사자 간 추가 논의를 통해 출시가 앞당겨질 수도 있다”고 조언했다. 이어 “스텔라라의 최초 적응증인 판상 건선으로 시밀러들의 임상 3상이 수행됐던 만큼, 내년 중에는 해당 질환 관련 출시부터 문제가 없도록 특허 전략을 갖추는 상황일 것”이라고 귀띔했다.









![결혼 앞둔 예비신부 사망…성폭행 뒤 살해한 그놈 정체는 [그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26031200001t.jpg)