|
8일(현지시간) 미국 식품의약국(FDA)이 비만 또는 과체중 성인의 만성 체중관리를 위해 주1회 주사제로 개발된 ‘젭바운드’를 승인했다고 밝혔다.
지난해 5월 미국에서 당뇨병 치료제 ‘마운자로’로 승인됐던 티르제파타이드의 적응증을 재창출한 것이 젭바운드로 알려졌다. 젭바운드는 글루카곤유사펩타이드-1(GLP-1) 계열 제제 중 임상에서 가장 체중감소 효과가 높았던 것으로 주목받았다. 특히 이 약물은 GLP-1 뿐만 아니라 ‘포도당 의존성 인슐린 친화 폴리펩타이드’(GIP)에 동시에 관여하는 이중작용제다.
현재까지 미국이나 유럽 연합(EU)에서 승인된 GLP-1 계열의 약물은 젭바운드를 포함해 노보 노디스크가 개발한 삭센다(성분명 리라글루타이드)와 위고비(성분명 세마글루타이드 등 3종뿐이다. 이들의 임상에서 나타난 효능은 젭바운드가 22~26%로 삭센다(10~15%), 위고비(약 20%)를 앞도하는 것으로 확인된 바 있다.
GLP-1 계열의 비만약 개발 업계 관계자는 “젭바운드가 허가될 것이라는 것은 공공연한 사실이었다”며 “가장 큰 미국시장에서 젭바운드와 위고비의 격돌을 지켜봐야한다”고 귀띔했다.
그는 이어 “효능이나 투약방법, 성인 대상이라는 적응증 등의 측면에서 사실상 동일선상에 있는 위고비와 젭바운드다. 앞으로 1~2년 사이 두 약물의 미국 시장 점유율을 추이를 보면 시장 주도 약물이 무엇이 될지 가늠좌가 될 것”이라고 말했다.
비만시장 올해 3배 껑충...“위고비 덕분, 젭바운드는 복병”
10일 제약바이오 업계에 따르면 지난해 비만 치료 시장 규모는 약 3조5000억~4조원 수준이다. 이중 삭센다가 2022년 107억 크로네(한화 약 2조원)의 매출을 올리며 시장을 선도하고 있다. 삭센다는 2014년 미국에서 GLP-1 계열 약물로는 최초로 비만약 지위를 획득했으며 2020년에는 성인에서 12세 이상 청소년으로 투약연령을 확대한 바 있다.
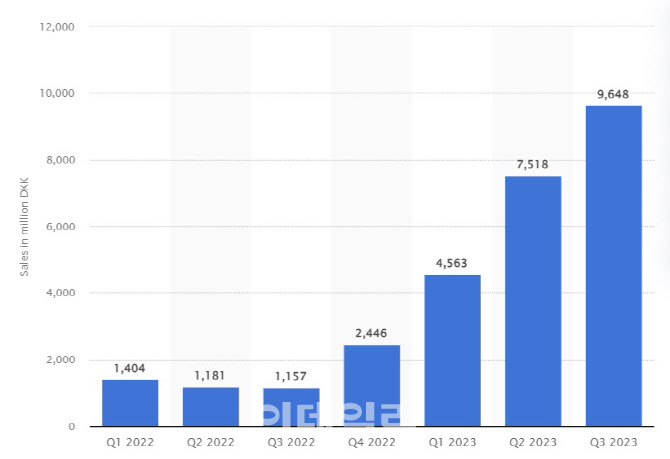
또 노보 노디스크가 삭센다의 후속작으로 내놓은 위고비의 상승세도 가파르다. 위고비는 2021년 6월과 2022년 1월 각각 미국과 EU에서 성인비만약으로 승인된 바 있다. 이 약물은 지난해 총 61억8800만 크로네(한화 약 1조1660억원)의 매출을 올렸다. 하지만 올해 3분기까지 위고비 매출은 217억4800만 크로네(한화 약 4조990억원)로 크게 뛰었다.
올들어 위고비 분기별 매출은 70~80% 이상 꾸준히 상승했다. 이 때문에 위고비의 4분기 매출은 160억 크로네 이상 달성할 것으로 전망되고 있다.
|
결국 위고비의 올해 매출은 400억 크로네(한화 약 7조5000억원) 수준까지 가능하다는 얘기다. 위고비 제품하나로 인해 사실상 비만 치료 시장 규모 자체가 전년의 3배인 약 11~12조원 수준으로 껑충 뛰어오를 수 있다는 얘기다.
이런 상황에서 최고 체중감소 효과를 자랑하는 젭바운드가 최대 시장인 미국에서 위고비의 대항마로 출격하게 된 셈이다. 업계 한 관계자는 “미국은 전산업군에서 자국 기업 제품을 우선하는 분위기가 다소 강하다. 제약 산업도 마찬가지다”며 “미국 기업이 개발한 젭바운드가 다른 나라는 몰라도 유통에 있어 미국에선 빠르게 시장을 넓힐 수 있을 것”이라고 전망했다.
한편 10일 기준 릴리의 시총은 5613억4000만 달러(한화 약 740조1200억원), 노보 노디스크는 4576억4000만 달러(한화 약 603조3980억원) 등으로 신약 개발 및 판매를 주요 사업으로하는 제약바이오 기업 중 시총 1위와 2위에 올라 있다.
‘한미·일동’ 등도 GLP-1 계열 비만약 韓임상 진입
국내에서는 한미약품과 일동제약 등이 GLP-1 제제 후보물질에 대해 임상 개발에 진입했다.
지난 7월 한미약품은 식품의약품안전처(식약처)에 자체 기술로 확보한 GLP-1 작용제 후보물질 ‘에페글레나타이드’ 에 대한 비만 대상 임상 3상 시험계획서(IND)를 제출했다. 회사 측은 2025년 에페글레나타이드의 국내 상용화를 목표로 하고 있다. 이외에도 2030년까지 최소 3개 이상의 비만 신약을 국내에서 출시하겠다는 계획이다.
일동제약(249420)은 지난 5일 GLP-1 작용 기전의 ‘ID11521156’을 발굴해 경구용 제형에 대한 국내 임상 1상을 승인받았다. 회사 측에 따르면 아직 해당 후보물질의 적응증을 확정하진 않았지만, 1상에서 안전성을 확인한 이후 비만 적응증으로 개발을 진행할 것으로 알려졌다.
이에 비만약 개발 업계 한 관계자는 “국내 임상을 하는 국내사가 한국인에 특화된 비만약 개발을 선언하고 있다”며 “해당 물질들의 개발 완료시점에는 해외 약물이 국내 도입되는 것을 고려해야 한다. 이미 사람들의 기준이 높아진 만큼 위고비나 젭바운드 수준의 효능이 나와야 시장성이 있을 것이다”고 조언했다.



![“얼굴 가리고 피투성이 딸 질질 끌고가”…팔순 아버지의 눈물[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26022000001t.jpg)

