|
28일 식품의약품안전처와 비비씨리서치(BBC Research)에 따르면 글로벌 마이크로바이옴 치료제(의약품) 시장 규모는 2018년 5630만달러(약 730억원)에서 2024년 167배 증가한 93억8750만달러(약 12조원)로 전망된다.
마이크로바이옴은 미생물(Microbe)과 생태계(Biome)의 합성어로 인간의 몸속에 존재하는 100조개 가량의 미생물과 유전자 정보 전체를 일컫는다. 몸속의 미생물들은 건강과 질병에 미치는 영향이 커서 ‘두 번째 유전체’라고도 불린다. 마이크로바이옴이 △건선 △역류성 식도염 △비만 △대장 △심혈관계 질환 등과 상관 관계가 있는 것으로 알려지면서 관련 마이크로바이옴 치료제 개발도 활발히 이뤄지고 있다.
특히 글로벌 첫 마이크로바이옴 치료제가 등장하면서 시장 성장에 대한 기대감도 커지고 있다. 페링제약은 지난해 11월 설사와 장염을 유발하는 클로스트리디움 디피실 감염증(CDI, Clostridium difficile infection) 적응증을 대상으로 한 마이크로바이옴 치료제 ‘레비요타(Rebyota·RBX2660)’로 미국 식품의약국(FDA)의 승인을 받았다.
클로스트리디움 디피실 감염증은 그동안 다른 사람의 건강한 대변을 이식하는 시술법 뿐이었지만 레비요타는 인간의 분변에서 추출한 미생물을 정제해 만든 마이크로바이옴 치료제로 직장을 통해 투약하는 것이 특징이다.
아울러 미국 세레스테라퓨틱스가 임상 3상에 성공한 클로스트리디움 디피실 감염증 경구용 마이크로바이옴 치료제 ‘SER-109’도 올해 상반기 FDA 승인을 받을 것으로 예상된다. 이 치료제는 세균 퍼미큐테스의 포자를 정제해 만들었으며 레비요타와 달리 먹는 형태로 개발돼 복용 편의성이 대폭 개선됐다는 평가를 받고 있다.
|
페링제약과 세레스테라퓨틱스 등 글로벌 제약·바이오기업들은 대부분 클로스트리디움 디피실 감염증 등 장 관련 질환을 치료 대상으로 하고 있지만 우리나라 제약·바이오기업들을 비롯한 후발 주자들은 건선과 면역항암제 등 다양한 적응증을 대상으로 한 마이크로바이옴 치료제 개발에 나서고 있다.
국내 기업 중에서는 지놈앤컴퍼니(314130)와 고바이오랩(348150)이 가장 앞서고 있다. 지놈앤컴퍼니의 대표적인 마이크로바이옴 치료제는 담도암과 위암 등 항암치료제다. 지놈앤컴퍼니의 경구용(먹는) 마이크로바이옴 면역항암제 파이프라인 ‘GEN-001’은 암 환자의 면역력 활성화를 통한 면역항암 효능이 있다는 평가를 받고 있다. 지놈앤컴퍼니는 현재 면역항암제(면역관문억제제)와 병용요법을 통해 위암과 담도암 치료제 등으로 개발하고 있다.
지놈앤컴퍼니는 머크·화이자의 면역항암제 ‘바벤시오’와 병용으로 개발 중인 위암 치료제의 국내 임상 2상 중간 결과를 이르면 올해 상반기 내 발표할 예정이다.
지놈앤컴퍼니는 머크의 ‘키트루다’와 병용으로 담도암 치료제를 개발하는 국내 임상 2상을 올해 하반기에 예정하고 있다. 아울러 지놈앤컴퍼니는 자회사 사이오토가 개발하고 있는 자폐스펙트럼(ASD) 치료제의 임상 1상을 마치고 임상 2상 진입을 준비 중이다.
지놈앤컴퍼니는 마이크로바이옴 의약품 위탁생산(CMO) 사업도 진행 중이다. 지놈앤컴퍼니는 2021년 미국 CMO 기업인 리스트랩 지분 60%를 2700만달러(당시 314억원)에 인수한뒤 생산시설 증설을 위해 미국에 리스바이오를 설립했다.
지놈앤컴퍼니 관계자는 “자사가 창업될 당시인 2015년에 장질환 관련 마이크로바이옴 연구는 이미 포화상태여서 처음부터 항암과 뇌질환을 대상으로 한 치료제를 개발하기로 했다”며 “올해 상반기 예정인 위암 치료제 임상 2상 중간 결과가 자사 마이크로바이옴 면역항암제 파이프라인에 대해 처음으로 유효성 데이터를 공개한다는 점에서 상당히 중요하다”고 말했다. 이어 “미국이 최근 자국 내 제품 생산을 강조하고 있는 만큼 미국 내 위탁생산시설이 있는 자사에 유리하게 작용하고 있다”고 덧붙였다.
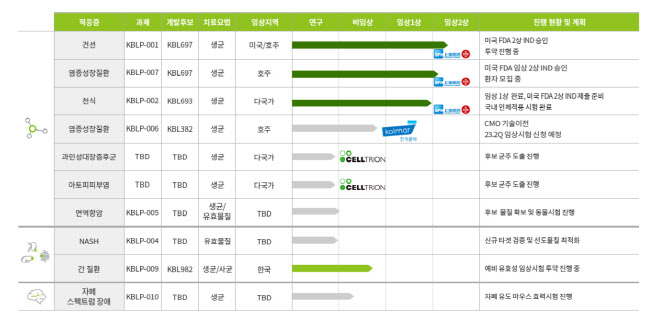
고바이오랩은 경구용 건선과 염증성장질환 치료제 등 총 10개의 마이크로바이옴 파이프라인을 보유 중이다. 이중 고바이오랩이 자체 발굴한 균주 ‘KBL697’을 기반으로 한 건선치료제는 미국 식품의약국(FDA) 임상 2상 시험계획(IND)을 승인받은 뒤 환자 투약을 진행 중이다. 건선치료제는 올해 상반기 내 환자 투약 완료 후 탑라인 데이터 확인이 가능할 전망이다. 염증성장질환(궤양성 대장염) 치료제는 미국 식품의약국 임상 2상 시험계획을 승인받은 뒤 환자 모집을 진행 중이다.
고바이오랩은 균주 ‘KBL693’을 기반으로 한 천식치료제의 임상 1상을 완료하고 미국 식품의약국 임상 2상 시험계획 제출을 준비하고 있다. 이밖에 고바이오랩은 면역 항암제의 후보물질 확보와 동물 시험을 진행 중이다. 고바이오랩은 셀트리온(068270)과 공동으로 과민성대사증후군과 아토피피부염 치료제 후보물질도 발굴하고 있다.
고바이오랩 관계자는 “마이크로바이옴 치료제의 가장 큰 장점은 체내 미생물을 기반으로 하기 때문에 다른 치료제와 비교해 독성이 낮아 안전성이 높다는 것”이라며 “자사 제품은 경구용이기 때문에 주사 치료제 등과 겸용 투여도 가능하고 단독 투여도 가능하다”고 말했다.




![아파트에서 숨진 트로트 여가수…범인은 전 남자친구였다 [그해 오늘]](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/12/PS24120100006t.jpg)