헬릭스미스는 올해 4월 18일 기재정정 공시를 통해 ALS 국내 임상 2a상 계획을 추가했다. 미국 국립보건원(NIH) 임상시험 정보 사이트 ‘클리니컬 트라이얼’에도 올해 1월 4일 새 임상시험계획서를 등록했다.
추가된 임상은 앞서 지난해 6월 16일 식품의약품안전처로부터 승인 받은 기존 임상2a상과 사실상 연장선상에 있는 임상이다. 임상 참여자들 중 동의한 환자들을 대상으로 약물의 안전성을 6개월 더 관찰하겠다는 것이 핵심이다. 기존 임상과 추가된 임상 모두 1차 지표를 안전성으로 설정했으며, 탐색적 지표로 설정한 근육 기능이나 근력 변화 등 유효성 항목도 상당 부분 일치한다.
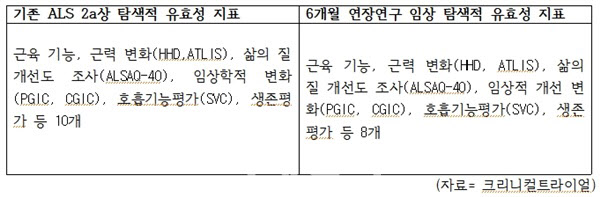
클리니컬 트라이얼에 따르면 기존 2a상 유효성 탐색적 지표는 근육 기능, 근력 변화(HHD,ATLIS), 임상학적 변화(PGIC, CGIC) 등 10개다. 6개월 연장 연구 임상의 유효성 탐색적 지표도 근육 기능, 근력 변화(HHD, ATLIS), 삶의 질 개선도 조사(ALSAQ-40), 임상적 개선 변화(PGIC, CGIC), 호흡기능평가(SVC), 생존평가 등 8개다.
|
공시 상으로는 임상시험계획 ‘변경’으로 돼 있지만, 회사 측은 두 임상은 별도 임상으로 다르다고 강조한다. 헬릭스미스 관계자는 “있던 걸 변경한 게 아니라 새로운 임상시험계획을 추가한 것”이라며 “a가 a'로 변경된 것처럼 보일 수 있는데, 그게 아니라 a와 b인 별개 임상이다”라고 설명했다. 다만 당시 헬릭스미스 공시를 담당했던 한국거래소 관계자는 “회사 측에 두 공시 차이가 뭐냐고 묻자 기간만 바뀐다고 답했다”며 “그렇다면 사실상 같은 임상이니, 기재정정으로 공시를 하는 게 맞다고 했고 회사 측도 이에 이견은 없었다”고 밝혔다.
주목할만한 점은 크리니컬 트라이얼에 새로 등록된 6개월 연장 연구 임상은 2b상으로 분류됐으며, 이 임상에서는 시험약의 추가 투약이나 임상적 처치 없이 1차 지표가 안전성으로 설정됐다는 것이다. 임상3상을 위한 후속 임상인 임상2b상 단계에서도 여전히 1차 지표를 안전성으로 본다면, 이론적으로 임상3상을 승인받을 근거가 상당히 약해진다는 분석이 전문가들 사이에서 나온다. 이전 임상 단계에서 기술에 대한 ‘개념 증명(Proof of Concept, PoC)’을 통해 다음 임상을 진행할 근거를 만들고 디자인을 짤 수 있는데, 이 경우 유효성을 충분히 입증할만한 데이터가 부족할 수 있어서다.
한 임상 디자인 전문가는 “루게릭병이라는 희귀질환 특성상 임상2상에서도 안전성을 볼 수는 있다. 항암제도 안전성을 추가로 보기 위해 소수 임상을 추가 하기도 한다”면서도 “하지만 결국 항암제도 유효성을 보지 않나. 임상2상은 그 결과를 근거로 3상 임상 가설을 결정하고 디자인과 환자 수를 정하는 과정이다. 헬릭스미스처럼 안전성만 계속 본다면 도대체 임상3상은 언제 할 건지에 대한 의문이 자연스레 든다”고 말했다.
또 다른 바이오 기업 임상 담당 임원은 “2b상이라고 하면 임상3상에 준하는 확증적 임상(Pivotal trial)에 가까운 임상인데, 일단 별도로 임상 디자인을 짠 배경도 일반적이지 않은데다, 이렇게 임상2b상까지 안전성을 설정한 것을 보면 임상3상을 어떻게 할 것인지 궁금해진다”고 짚었다.
또 이러한 임상 설계로는 희귀의약품과 패스트트랙 개발 의약품에 부여될 수 있는 혜택을 제대로 누리지 못할 수 있다는 의견도 있다. 헬릭스미스 엔젠시스는 앞서 지난 2016년 미국 식품의약국(FDA)으로부터 ALS에 대한 희귀의약품과 패스트트랙으로 각각 지정된 바 있다.
패스트트랙 지정은 신약 허가를 신청(NDA)할 때 가속 승인(Accelerated Approval)과 우선 심사(Priority Review)를 신청할 수 있다. 가속승인은 심각한 질환에 대한 치료제에 대해 약효가 기존 치료법 대비 의미있는 개선을 보이는 경우 임상적 대리지표를 충족하는 임상 결과로 승인을 내주는 제도다. 통상 기존 표준 치료법과 비교해 안전성·유효성 지표에서 우월성이 입증될 경우 임상2상 결과만으로도 이러한 승인 신청이 가능하다. 하지만 헬릭스미스의 이번 임상2상 디자인으로는 승인 가능성이 거의 없다는 게 전문가들 분석이다.
한 바이오 기업 관계자는 “헬릭스미스의 임상2상 디자인에 따르면 승인을 해줄만한 레퍼런스가 없어 사실상 임상3상을 해야한다. 결국 희귀의약품 지정을 통한 가속승인 제도 혜택을 전혀 누리지 못하는 것”이라고 말했다.
이대로라면 헬릭스미스가 ALS 2c상을 추진할 수 있다는 의견도 있다. 다만 이 단계까지 거치면 임상 기간이 예상보다 길어질 뿐 아니라 비용도 만만찮게 들 것이란 분석이 나온다. 실제 회사가 지난 2일 발표한 ALS 2a상 톱라인 데이터는 처음 클리니컬 트라이얼 사이트에 임상2a상이 등록된 지난 2020년 11월 17일 이후 1년 9개월 여만에 나왔다. 여기다 6개월 연장 임상 기간까지 추가돼 결과를 보려면 내년까지는 기다려야 한다는 전망이 나온다.
임상 디자인 전문가는 “임상3상의 경우 많은 모수를 필요로 하다 보니, 여러 번 진행할 수 있다. 하지만 보통 업계에서는 그걸 나누진 않는데, 헬릭스미스는 당뇨병성 신경병증(DPN) 임상에서 3-1상, 3-2상 이런 식으로 직접 쪼갰다”며 “이런 논리라면 임상2상에서도 2c, 2d가 나올 가능성이 있다”고 말했다.
이어 “내년 초부터 2c상을 준비한다고 해도 승인 신청, 허가, 환자 모집 등에 걸리는 시간만 단순 계산해봐도 2년 이상 걸리고, 환자 수도 늘린다면 또 다시 모집에 시간이 걸린다. 그런 가능성들을 고려하면 적어도 5~7년이라는 계산이 나온다. 비용도 500억원 이상 들어갈 수 있다”며 “6개월 연장 연구에서 유효성 데이터를 내지 못한다면 상식적으로 추가 임상을 할 이유는 없다고 본다”고 덧붙였다. 이에 대해 헬릭스미스 측 입장을 물었지만 답변을 내놓지 않았다.
헬릭스미스 관계자는 임상을 별도로 진행하는 이유를 묻는 질문에 대해서는 “연장연구는 ALS 2a상 참여 환자 중 별도 임상참여동의서를 받아 별도의 프로토콜로 진행한 별도의 연구다. NCT 번호도 별도로 있다”고만 답했다.



!['과대망상'이 부른 비극…어린 두 아들 목 졸라 살해한 母[그해 오늘]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021700001t.jpg)
